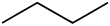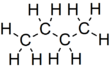বিউটেন
বিউটেন ( /ˈbjuːteɪn/ ) বা n -বিউটেন হল একটি অ্যালকেন যার রাসায়নিক সংকেত C4H10। বিউটেন হল একটি অত্যন্ত দাহ্য, বর্ণহীন, সহজে তরলীকৃত গ্যাস যা কক্ষ তাপমাত্রা এবং চাপে দ্রুত বাষ্পীভূত হয়ে যায়। বিউটেন নামটি মূল এসেছে but- ( butyric অ্যাসিড থেকে, মাখনের জন্য ব্যবহৃত গ্রীক শব্দ) এবং প্রত্যয় -ane যোগে। এটি অপরিশোধিত পেট্রোলিয়াম থেকে ১৮৬৪ সালে এডমন্ড রোনাল্ডস আবিষ্কার করেন। যিনি প্রথম এর বৈশিষ্ট্য বর্ণনা করেন।[৪] [৫] ওয়াল্টার ও. স্নেলিং ১৯১০ এর দশকের শুরুতে এর বাণিজ্যিকীকরণ করেন।
| |||
| |||
| নামসমূহ | |||
|---|---|---|---|
| ইউপ্যাক নাম
Butane[১]
| |||
| শনাক্তকারী | |||
ত্রিমাত্রিক মডেল (জেমল)
|
|||
| বেইলস্টেইন রেফারেন্স | 969129 | ||
| সিএইচইবিআই | |||
| সিএইচইএমবিএল | |||
| কেমস্পাইডার | |||
| ইসিএইচএ ইনফোকার্ড | ১০০.০০৩.১৩৬ | ||
| ইসি-নম্বর |
| ||
| ই নম্বর | E৯৪৩a (গ্লেজিং এজেন্ট, ...) | ||
| মেলিন রেফারেন্স | 1148 | ||
| কেইজিজি | |||
| এমইএসএইচ | butane | ||
পাবকেম CID
|
|||
| আরটিইসিএস নম্বর |
| ||
| ইউএনআইআই | |||
| ইউএন নম্বর | 1011 | ||
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|||
| |||
| |||
| বৈশিষ্ট্য | |||
| C4H10 | |||
| আণবিক ভর | ৫৮.১২ g·mol−১ | ||
| বর্ণ | Colorless gas | ||
| গন্ধ | Odorless | ||
| ঘনত্ব | 2.48 kg/m3 (at 15 °C) | ||
| গলনাঙ্ক | −১৪০ ডিগ্রি সেলসিয়াস; −২২০ ডিগ্রি ফারেনহাইট; ১৩৩ kelvin | ||
| স্ফুটনাঙ্ক | −১ ডিগ্রি সেলসিয়াস; ৩০ ডিগ্রি ফারেনহাইট; ২৭২ kelvin | ||
| 61 mg L−1 (at 20 °C) | |||
| লগ পি | 2.745 | ||
| বাষ্প চাপ | ~25 PSI (at 50 °F) [২] | ||
| কেএইচ | 11 nmol Pa−1 kg−1 | ||
| তাপ রসায়নবিদ্যা | |||
| তাপ ধারকত্ব, C | 98.49 J K−1 mol−1 | ||
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−126.3–−124.9 kJ mol−1 | ||
| দহনে প্রমান এনথ্যাল্পির পরিবর্তন ΔcH |
−2.8781–−2.8769 MJ mol−1 | ||
| ঝুঁকি প্রবণতা | |||
| জিএইচএস চিত্রলিপি | 
| ||
| জিএইচএস সাংকেতিক শব্দ | বিপদজনক | ||
| জিএইচএস বিপত্তি বিবৃতি | H220 | ||
| জিএইচএস সতর্কতামূলক বিবৃতি | P210 | ||
| এনএফপিএ ৭০৪ | |||
| ফ্ল্যাশ পয়েন্ট | −৬০ ডিগ্রি সেলসিয়াস (−৭৬ ডিগ্রি ফারেনহাইট; ২১৩ kelvin) | ||
| বিস্ফোরক সীমা | 1.8–8.4% | ||
| সম্পর্কিত যৌগ | |||
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |||
| তথ্যছক তথ্যসূত্র | |||
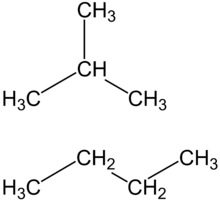
বিউটেনের দুটি আইসোমার বা সমাণু আছে। n-বিউটেন এবং আইসো বিউটেন। আইসো বিউটেনের আরেকটি নাম মিথাইল প্রোপেন। এটি মূলত জ্বালানি হিসেবে ব্যবহার করা হয়। বিউটেন হল তরলীকৃত পেট্রোলিয়াম গ্যাসের (LP গ্যাস) একটি গ্রুপ। অন্যান্যগুলোর মধ্যে আছে প্রোপেন, প্রোপিলিন, বিউটাডাইইন, বিউটাইলিন, আইসোবিউটাইলিন এবং এর মিশ্রণ। বিউটেন পেট্রল এবং কয়লার চেয়ে বেশি পরিষ্কারভাবে পোড়ায়।
নামকরণ
সম্পাদনাঅজৈব রসায়নের নামকরণের আন্তর্জাতিক সংস্থা আইইউপিএসি অনুসারে বিউটেনের নামকরণ করা হয়েছে। এখানে বিউট দ্বারা যৌগে চার কার্বনের উপস্থিতি বোঝানো হয়েছে।
- বিউটেনের রাসায়নিক সংকেতঃ C4H10
- বিউটেনের গাঠনিক সংকেতঃ CH3-CH2-CH2-CH3
ইতিহাস
সম্পাদনাব্রিটিশ রসায়নবিদ এডওয়ার্ড ফ্রাঙ্কল্যান্ড ১৮৪৯ সালে ইথাইল আয়োডাইড এবং জিঙ্ক থেকে বিউটেনের প্রথম ঘটনাক্রমে সংশ্লেষণ করেছিলেন। কিন্তু তিনি বুঝতে পারেননি যে ইথাইল র্যাডিক্যাল ডাইমারাইজড হয়েছে এবং পদার্থটিকে ভুল শনাক্ত করেছেন। [৬]
বিউটেনের সঠিক আবিষ্কারক এটিকে " বিউটাইলের হাইড্রাইড" বলে অভিহিত করেছেন, [৭] তবে ইতোমধ্যে ১৮৬০-এর দশকে আরও নাম ব্যবহার করা হয়েছিল: "বিউটাইল হাইড্রাইড", [৮] "টেট্রিলের হাইড্রাইড" [৯] এবং "টেট্রিল হাইড্রাইড", [১০] "ডাইইথাইল" বা "ইথাইল ইথাইলাইড" [১১] এবং অন্যান্য। অগাস্ট উইলহেম ফন হফম্যান তার ১৮৬৬ সালের পদ্ধতিগত নামকরণে "কোয়ার্টেন" নামটি প্রস্তাব করেন, এবং ১৮৭৪ সালের দিকে জার্মান থেকে ইংরেজিতে আধুনিক নামটি চালু হয়। [১২]
১৯১০-এর দশক পর্যন্ত বিউটেনের খুব বেশি প্রায়োগিক ব্যবহার ছিল না, যখন ডব্লিউ. স্নেলিং গ্যাসোলিনের উপাদান হিসাবে বিউটেন এবং প্রোপেনকে চিহ্নিত করেছিলেন এবং দেখেছিলেন যে সেগুলিকে ঠান্ডা করা হলে, চাপযুক্ত পাত্রে একটি আয়তন-হ্রাসযুক্ত তরল অবস্থায় সংরক্ষণ করা যেতে পারে।
ঘনত্ব
সম্পাদনাবিউটেনের ঘনত্ব পাত্রের তাপমাত্রা এবং চাপের উপর অত্যন্ত নির্ভরশীল। [১৩] উদাহরণস্বরূপ, তরল প্রোপেনের ঘনত্ব 571.8±1kg/m 3 (2MPa পর্যন্ত চাপের জন্য এবং তাপমাত্রা 27±0.2°C), যখন তরল বিউটেনের ঘনত্ব হল 625.5±0.7kg/m 3 (2MPa পর্যন্ত চাপের জন্য এবং তাপমাত্রা -13±0.2°সে)।
সমানুতা
সম্পাদনা| সাধারণ নাম | স্বাভাবিক বিউটেনশাখাবিহীন বিউটেনn -বুটানে | আইসোবুটেনi- বুটানে |
| IUPAC নাম | বুটেন | মিথাইলপ্রোপেন |
| আণবিক
চিত্র |
||
| গাঠনিক
চিত্র |
কেন্দ্রীয় C−C বন্ড ঘূর্ণন n -বিউটেনের জন্য দুটি ভিন্ন রূপ ( ট্রান্স এবং গাউচে ) তৈরি করে। [১৫]
রাসায়নিক বিক্রিয়া
সম্পাদনাযখন অক্সিজেন প্রচুর থাকে, তখন বিউটেন পুড়ে কার্বন ডাই অক্সাইড এবং জলীয় বাষ্প তৈরি করে; অক্সিজেন সীমিত হলে, কার্বন ( কাঁচ ) বা কার্বন মনোক্সাইডও তৈরি হতে পারে। বিউটেন বাতাসের চেয়ে ঘন।
পর্যাপ্ত অক্সিজেনের উপস্থিতিতে:
2C4H10 + 13 O2 → 8 CO2 + 10 H2O
অপর্যাপ্ত অক্সিজেনের উপস্থিতিতে:
2C4H10 + 9 O2 → 8 CO + 10 H4O
ওজন অনুসারে, বিউটেনে রয়েছে প্রায় লুয়া ত্রুটি মডিউল:Convert এর 670 নং লাইনে: attempt to index field 'per_unit_fixups' (a nil value)। বা তরল ভলিউম দ্বারা লুয়া ত্রুটি মডিউল:Convert এর 670 নং লাইনে: attempt to index field 'per_unit_fixups' (a nil value)। ।
বিউটেনের সর্বাধিক অ্যাডিয়াব্যাটিক শিখা তাপমাত্রা বাতাসের সাথে ২,২৪৩ kelvin (১,৯৭০ ডিগ্রি সেলসিয়াস; ৩,৫৭৮ ডিগ্রি ফারেনহাইট)।
n -বিউটেন হল ম্যালিক অ্যানহাইড্রাইড তৈরির জন্য ডুপন্টের অনুঘটক প্রক্রিয়ার জন্য ফিডস্টক:
2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O
n -বিউটেন সমস্ত হাইড্রোকার্বনের মত ফ্রি র্যাডিকাল ক্লোরিনেশনের মধ্য দিয়ে যায় যা 1-ক্লোরো- এবং 2-ক্লোরোবিউটেন উভয়ই প্রদান করে। সেইসাথে আরও বেশি ক্লোরিনযুক্ত ডেরিভেটিভস প্রদান করে। ৪২৫ এবং ৪১১ kJ /mol দুই ধরনের CH বন্ডের জন্য ক্লোরিনেশনের আপেক্ষিক হার ভিন্ন ধরনের বন্ড ডিসোসিয়েশন এনার্জি দ্বারা আংশিকভাবে ব্যাখ্যা করা হয়েছে।
ব্যবহার
সম্পাদনাসাধারণ বিউটেন গ্যাসোলিন মিশ্রণের জন্য ব্যবহার করা যেতে পারে, জ্বালানী গ্যাস হিসাবে, সুগন্ধ নিষ্কাশন দ্রাবক, একা বা প্রোপেনের মিশ্রণে, এবং সিন্থেটিক রাবারের প্রধান উপাদান ইথিলিন এবং বিউটাডিন তৈরির জন্য একটি ফিডস্টক হিসাবে ব্যবহার করা যায়। আইসোবিউটেন প্রাথমিকভাবে রিফাইনারিতে মোটর পেট্রলের অকটেন সংখ্যা বাড়ানোর (বৃদ্ধি) জন্য ব্যবহৃত হয়। [১৬] [১৭] [১৮] [১৯]
পেট্রোল মিশ্রনের জন্য, এন-বিউটেন হল প্রধান উপাদান যা রিড বাষ্প চাপ (RVP) ম্যানিপুলেট করতে ব্যবহৃত হয়। যেহেতু শীতকালীন জ্বালানীতে ইঞ্জিন চালু করার জন্য অনেক বেশি বাষ্পচাপ প্রয়োজন হয় তাই শোধনাগারগুলি জ্বালানীতে আরও বিউটেন মিশ্রিত করে RVP বাড়ায়। [২০] এন-বিউটেনের তুলনামূলকভাবে উচ্চ গবেষণার অকটেন নম্বর (RON) এবং মোটর অকটেন নম্বর (MON), যা যথাক্রমে ৯৩ এবং ৯২। [২১]
প্রোপেন এবং অন্যান্য হাইড্রোকার্বনের সাথে মিশ্রিত করা হলে, মিশ্রণটিকে বাণিজ্যিকভাবে তরলীকৃত পেট্রোলিয়াম গ্যাস (এলপিজি) হিসাবে উল্লেখ করা যেতে পারে। এটি পেট্রোল উপাদান হিসাবে, বাষ্প ক্র্যাকিংয়ে বেস পেট্রোকেমিক্যাল উৎপাদনের জন্য ফিডস্টক হিসাবে, সিগারেট লাইটারের জ্বালানী হিসাবে এবং ডিওডোরেন্টের মতো অ্যারোসল স্প্রেতে প্রপেলান্ট হিসাবে ব্যবহৃত হয়। [২২]
বিউটেনের বিশুদ্ধ রূপ, বিশেষ করে আইসোবিউটেন রেফ্রিজারেন্ট হিসাবে ব্যবহৃত হয় এবং রেফ্রিজারেটর, ফ্রিজার এবং এয়ার কন্ডিশনার সিস্টেমে ওজোন-স্তর-ক্ষয়কারী হ্যালোমেথেনগুলিকে মূলত প্রতিস্থাপিত করেছে। বিউটেনের অপারেটিং চাপ ফ্রেয়ন-12 (R-12) এর মতো হ্যালোমেথেনগুলির তুলনায় কম। তাই R-12 সিস্টেম যেমন স্বয়ংচালিত এয়ার কন্ডিশনার সিস্টেমে যখন বিশুদ্ধ বিউটেনে রূপান্তরিত হয় তখন দুর্বলভাবে কাজ করবে। এর পরিবর্তে আইসোবিউটেন এবং প্রোপেনের মিশ্রণ ব্যবহার করা হয় শীতলকারী প্রক্রিয়ার(কুলিং সিস্টেম) কার্যকারিতা দিতে যা R-12 ব্যবহারের সাথে তুলনা করা যায়।
সাধারণ লাইটার বা বিউটেন টর্চের জন্য হালকা জ্বালানি হিসেবেও বিউটেন ব্যবহার করা হয় এবং রান্না, বারবিকিউ এবং ক্যাম্পিং স্টোভের জ্বালানি হিসেবে বোতলজাত বিউটেন বিক্রি করা হয়। ২০ শতকে জার্মানির ব্রাউন (কোম্পানি) একটি কর্ডলেস হেয়ার স্টাইলিং ডিভাইস পণ্য তৈরি করেছিল যা বাষ্প উত্পাদন করতে তার তাপের উৎস হিসাবে বিউটেন ব্যবহার করে। [২৩]
জ্বালানী হিসাবে এটি প্রায়শই স্বল্প পরিমাণে মারকাপটানের সাথে মেশানো হয় যাতে অপুর্ণ গ্যাসকে একটি আপত্তিকর গন্ধ দেওয়া হয় যা মানুষের নাক দ্বারা সহজেই সনাক্ত করা যায়। এইভাবে, বিউটেন ছড়িয়ে পড়া সহজেই চিহ্নিত করা যেতে পারে। হাইড্রোজেন সালফাইড এবং মারকাপটান বিষাক্ত হলেও তারা এত কম মাত্রায় উপস্থিত থাকে যে বিউটেনের দ্বারা দমবন্ধ হওয়া এবং আগুনের ঝুঁকি বিষাক্ত হওয়ার আগে সতর্ক হয়ে ওঠা যায়। [২৪] [২৫] বেশিরভাগ বাণিজ্যিকভাবে উপলব্ধ বিউটেনে কিছু দূষিত তেলও রয়েছে যা পরিস্রাবণের মাধ্যমে অপসারণ করা হয়। অন্যথায় ইগনিশন বিন্দুতে একটি জমা রেখে যাবে এবং অবশেষে গ্যাসের অভিন্ন প্রবাহকে বাধা দিতে পারে। [২৬]
সুগন্ধি নিষ্কাশনের জন্য দ্রাবক হিসাবে ব্যবহৃত বিউটেনে এই দূষিত পদার্থগুলি থাকে না [২৭] এবং বিউটেন গ্যাস দুর্বল বায়ুচলাচল এলাকায় গ্যাস বিস্ফোরণ ঘটাতে পারে যদি বিউটেন নিঃসরণ সনাক্ত করা না হয় ও কোন প্রকার আগুনের শিখার দ্বারা অগ্ন্যুৎপাতের সূত্রপাত হয়। ক্যানাবিস তেলের শিল্প নিষ্কাশনে বিশুদ্ধ বিউটেন দ্রাবক হিসাবে ব্যবহৃত হয়।
প্রভাব এবং স্বাস্থ্য ঝুঁকি
সম্পাদনাবিউটেনের শ্বাস-প্রশ্বাসের ফলে উচ্ছ্বাস, তন্দ্রা, অচেতনতা, শ্বাসরোধ, কার্ডিয়াক অ্যারিথমিয়া, রক্তচাপের ওঠানামা এবং অস্থায়ী স্মৃতিশক্তি হ্রাস হতে পারে, যখন উচ্চ চাপযুক্ত পাত্র থেকে সরাসরি অপব্যবহার করা হয় তখন শ্বাসরোধ এবং ভেন্ট্রিকুলার ফাইব্রিলেশন থেকে মৃত্যু হতে পারে। এটি রক্ত সরবরাহে প্রবেশ করে এবং কয়েক সেকেন্ডের মধ্যে নেশা তৈরি করে। [২৮] বিউটেন হল যুক্তরাজ্যে সবচেয়ে বেশি অপব্যবহার করা উদ্বায়ী পদার্থ এবং ২০০০ সালে দ্রাবক সম্পর্কিত মৃত্যুর ৫২% কারণ ছিল। [২৯] সরাসরি গলায় বিউটেন স্প্রে করলে, তরলের জেট দ্রুত −২০ ডিগ্রি সেলসিয়াস (−৪ ডিগ্রি ফারেনহাইট) পর্যন্ত ঠান্ডা হতে পারে। সম্প্রসারণ দ্বারা, দীর্ঘায়িত ল্যারিনগোস্পাজম সৃষ্টি করে। [৩০] "হঠাৎ স্নিফারের মৃত্যু" সিন্ড্রোম, প্রথম ১৯৭৯ সালে বাস বর্ণনা করেন, [৩১] দ্রাবক সম্পর্কিত মৃত্যুর সবচেয়ে সাধারণ একক কারণ, যার ফলে ৫৫% মারাত্মক ঘটনা ঘটে। [৩০]
আরো পড়ুন
সম্পাদনাতথ্যসূত্র
সম্পাদনা- ↑ পাবক্যাম থেকে সিআইডি 7843
- ↑ W. B. Kay। "Pressure-Volume-Temperature Relations for n-Butane"। Standard Oil Company।
- ↑ "Safety Data Sheet, Material Name: N-Butane" (পিডিএফ)। USA: Matheson Tri-Gas Incorporated। ৫ ফেব্রুয়ারি ২০১১। ১ অক্টোবর ২০১১ তারিখে মূল (PDF) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১১ ডিসেম্বর ২০১১।
- ↑ Watts, H.; Muir, M. M. P. (১৮৯৪)। Watts' Dictionary of Chemistry। Watts' Dictionary of Chemistry। Longmans, Green। পৃষ্ঠা 385।
- ↑ Maybery, C. F. (১৮৯৬)। "On the Composition of the Ohio and Canadian Sulphur Petroleums": 1–66। জেস্টোর 20020618। ডিওআই:10.2307/20020618।
- ↑ Seyferth, Dietmar (২০০১)। "Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry": 2940–2955। ডিওআই:10.1021/om010439f ।
- ↑ "Journal of the Chemical Society"। ১৮৬৫।
- ↑ Norman Tate, A. (১৮৬৩)। "Petroleum and Its Products: An Accoumt of the Properties, Uses, and Commercial Value Etc., of Petroleum, the Methods Employed in Refining it and the Properties, Uses, Etc., of Its Product"।
- ↑ Watts, Henry (১৮৬৫)। "A Dictionary of Chemistry"।
- ↑ Miller, William Allen (১৮৬৭)। "Elements of chemistry pt. 3 1867"।
- ↑ Miller, William Allen (১৮৬৯)। "Elements of Chemistry: Theoretical and Practical: Organic chemistry"।
- ↑ Schorlemmer, Carl (১৮৭৪)। "A Manual of the Chemistry of the Carbon Compounds: Or, Organic Chemistry"।
- ↑ Zivenko, Oleksiy (২০১৯)। "LPG Accounting Specificity During ITS Storage and Transportation" (ইংরেজি ভাষায়): 21–27। আইএসএসএন 0368-6418। ডিওআই:10.23939/istcmtm2019.03.021 ।
- ↑ Zivenko, Oleksiy (২০১৯)। "LPG Accounting Specificity During ITS Storage and Transportation" (ইংরেজি ভাষায়): 21–27। আইএসএসএন 0368-6418। ডিওআই:10.23939/istcmtm2019.03.021 ।
- ↑ Roman M. Balabin (২০০৯)। "Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane": 1012–9। ডিওআই:10.1021/jp809639s। পিএমআইডি 19152252।
- ↑ MarkWest Energy Partners, L.P. Form 10-K. Sec.gov.
- ↑ Copano Energy, L.L.C. Form 10-K. Sec.gov.
- ↑ Targa Resources Partners LP Form10-k.
- ↑ Crosstex Energy, L.P. FORM 10-K. Sec.gov.
- ↑ Maurice Stewart, Ken Arnold। "Reid Vapour Pressure"। Science Direct। ১৩ জুন ২০২০ তারিখে মূল থেকে আর্কাইভ করা।
- ↑ Jechura, John। "octane rating" (পিডিএফ)। Colorado School of Mines। ১ মে ২০১৫ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা।
- ↑ A Primer on Gasoline Blending ওয়েব্যাক মেশিনে আর্কাইভকৃত ৩০ জুন ২০১৩ তারিখে.
- ↑ "Braun C 100 TS Styling Iron User Manual Type 3589"। Inmar-OIQ, LLC। n.d.।
- ↑ Gresham, Chip (১৬ নভেম্বর ২০১৯)। "Hydrogen Sulfide Toxicity: Practice Essentials, Pathophysiology, Etiology" । Medscape Reference। সংগ্রহের তারিখ ২২ মার্চ ২০২১।
- ↑ Committee on Acute Exposure Guideline Levels; Committee on Toxicology (২৬ সেপ্টেম্বর ২০১৩)। 2. Methyl Mercaptan Acute Exposure Guideline Levels। NCBI Bookshelf। National Academies Press (US)।
- ↑ "BHO Mystery Oil"। Skunk Pharm Research। ২০১৩-০৮-২৬। সংগ্রহের তারিখ ২০১৯-১২-০৫।
- ↑ "Final Report of the Safety Assessment of Isobutane, Isopentane, n-Butane, and Propane"। SAGE Publications। ১৯৮২: 127–142। আইএসএসএন 0730-0913। ডিওআই:10.3109/10915818209021266।
- ↑ "Neurotoxic Effects from Butane Gas"। thcfarmer.com। ১৯ ডিসে ২০০৯। সংগ্রহের তারিখ ৩ অক্টোবর ২০১৬।
- ↑ "Trends in death Associated with Abuse of Volatile Substances 1971–2004" (পিডিএফ)। Department of Public Health Sciences. London: St George’s Medical School। মার্চ ২৭, ২০০৭ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা।
- ↑ ক খ Ramsey J, Anderson HR, Bloor K (১৯৮৯)। "An introduction to the practice, prevalence and chemical toxicology of volatile substance abuse": 261–269। ডিওআই:10.1177/096032718900800403। পিএমআইডি 2777265।
- ↑ Bass M (১৯৭০)। "Sudden sniffing death": 2075–2079। ডিওআই:10.1001/jama.1970.03170250031004। পিএমআইডি 5467774।