হাইড্রোজেন সালফাইড
হাইড্রোজেন সালফাইড একটি রাসায়নিক যৌগ যার রাসায়নিক সংকেত H
2S। এটি বর্ণহীন, পঁচা ডিমের গন্ধযুক্ত গ্যাস, এটা বাতাসের থেকে ভারী, বিষাক্ত, ক্ষয়কারক, দাহ্য এবং বিষ্ফোরক পদার্থ।
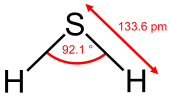
| |
| নামসমূহ | |
|---|---|
| পদ্ধতিগত ইউপ্যাক নাম
Hydrogen sulfide[১] | |
| অন্যান্য নাম
ডাইহাইড্রোজেন মনোসালফাইড
ডাইহাইড্রোজেন সালফাইড | |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| থ্রিডিমেট | |
| বেইলস্টেইন রেফারেন্স | 3535004 |
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৯.০৭০ |
| ইসি-নম্বর |
|
| মেলিন রেফারেন্স | 303 |
| কেইজিজি | |
| এমইএসএইচ | Hydrogen+sulfide |
পাবকেম CID
|
|
| আরটিইসিএস নম্বর |
|
| ইউএনআইআই | |
| ইউএন নম্বর | 1053 |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| বৈশিষ্ট্য | |
| H2S | |
| আণবিক ভর | ৩৪.০৮ g·mol−১ |
| বর্ণ | Colorless gas |
| গন্ধ | faint rotten egg |
| ঘনত্ব | 1.363 g dm−3 |
| গলনাঙ্ক | −৮২ °সে (−১১৬ °ফা; ১৯১ K) |
| স্ফুটনাঙ্ক | −৬০ °সে (−৭৬ °ফা; ২১৩ K) |
| 4 g dm−3 (at 20 °C) | |
| বাষ্প চাপ | 1740 kPa (at 21 °C) |
| অম্লতা (pKa) | 7.0[২][৩] |
| Basicity (pKb) | 6.95 |
| প্রতিসরাঙ্ক (nD) | 1.000644 (0 °C)[৪] |
| গঠন | |
| Point group | C2v |
| আণবিক আকৃতি | Bent |
| ডায়াপল মুহূর্ত | 0.97 D |
| তাপ রসায়নবিদ্যা | |
| তাপ ধারকত্ব, C | 1.003 J K−1 g−1 |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
206 J•mol−1•K−1[৫] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−21 kJ•mol−1[৫] |
| ঝুঁকি প্রবণতা | |
ইইউ শ্রেণীবিভাগ (ডিএসডি)
|
|
| আর-বাক্যাংশ | আর১২, আর২৬, আর৫০ |
| এস-বাক্যাংশ | (এস১/২), এস৯, এস১৬, এস৩৬, এস৩৮, এস৪৫, এস৬১ |
| এনএফপিএ ৭০৪ | |
| ফ্ল্যাশ পয়েন্ট | −৮২.৪ °সে (−১১৬.৩ °ফা; ১৯০.৮ K) |
| ২৩২ °সে (৪৫০ °ফা; ৫০৫ K) | |
| বিস্ফোরক সীমা | 4.3–46% |
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH): | |
PEL (অনুমোদনযোগ্য)
|
C 20 ppm; 50 ppm [10-minute maximum peak][৬] |
REL (সুপারিশকৃত)
|
C 10 ppm (15 mg/m3) [10-minute][৬] |
IDLH (তাৎক্ষণিক বিপদ
|
100 ppm[৬] |
| সম্পর্কিত যৌগ | |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
জলাশয় এবং স্যাঁতসেঁতে স্থানে অক্সিজেনের অনুপস্থিতিতে জৈব পদার্থের ব্যাকটেরিয় ভাঙনে হাইড্রোজেন সালফাইড উৎপন্ন হয়। আগ্নেয়গিরীর গ্যাসে, প্রাকৃতিক গ্যাসে, কূপের জলে H
2S উপস্থিতি লক্ষ্য করা যায়। মানব শরীরে খুবই সামান্য পরিমাণে H
2S উৎপন্ন হয়।
জলে দ্রবীভূত হাইড্রোজেন সালফাইড গ্যাস হাইড্রোসালফিউরিক এসিড নামে পরিচিত। সংক্ষেপে এটাকে সালফাইড্রিক এসিড নামে অভিহিত করা হয়। এটি একটি দূর্বল এসিড। ১৭৭৭ সালে সুইডিশ রসায়নবিদ কার্ল উইলহেম শিলি হাইড্রোজেন সালফাইড আবিষ্কার করেন। হাইড্রোজেন সালফাইডের ব্রিটিশ ইংরেজিতে বানান hydrogen sulphide, কিন্তু IUPAC এবং রয়্যাল সোসাইটি অভ কেমিস্ট্রি এই বানান গ্রহণ করে না। ২০১৪ সালে উচ্চ চাপে এবং 190K (-118 °F; -83.33 °C) তাপমাত্রায় হাইড্রোজেন সালফাইড সুপারকন্ডাক্টর ধর্ম প্রদর্শন করে, যা এখনো পর্যন্ত সর্বোচ্চ তাপমাত্রার সুপারকন্ডাক্টর।[৮]
বৈশিষ্ট্য
সম্পাদনাহাইড্রোজেন সালফাইড বাতাসের থেকে সামান্য ভারী;H
2S এবং বাতাসের মিশ্রণ বিস্ফোরণ ঘটাতে পারে। হাইড্রোজেন সালফাইড এবং অক্সিজেনের দহনে সালফার ডাইঅক্সাইড (SO
2) এবং পানি উৎপন্ন হয়। হাইড্রোজেন সালফাইড একটি বিজারক।
উচ্চতাপমাত্রা অথবা প্রভাবকের উপস্থিতিতে সালফার ডাই অক্সাইড হাইড্রোজেন সালফাইডের সাথে বিক্রিয়া করে সালফার এবং পানি উৎপন্ন করে।
হাইড্রোজেন সালফাইড পানিতে সামান্য দ্রবীভূত হয় এবং দূর্বল এসিড তৈরী করে, দ্রবণে হাইড্রোসালফাইড আয়ন HS− প্রদান করে (pKa = 6.9 in 0.01-0.1 mol/litre solutions at 18 °C)। পানিতে দ্রবীভূত হাইড্রোজেন সালফাইড সালিফাইড্রিক এসিড বা হাইড্রোসালফিউরিক এসিড নামে পরিচিত। এসিড দ্রবণ প্রথমে পরিষ্কার থাকলেও পরে ঘোলাটে রঙ ধারণ করে। কারণ পানিতে দ্রবীভূত অক্সিজেন এবং হাইড্রোজেন সালফাইডের ধীর বিক্রিয়ায় সালফাল ধাতুর অধঃক্ষেপ পড়ে। শক্তিশালি ক্ষারীয় জলীয় দ্রবনে সালফাইড ডাইএনায়ন S2− উপস্থিত থাকে।
হাইড্রোজেন সালফাইড ধাতব আয়নের সাথে বিক্রিয়া করে ধাতব সালফাইড গঠন যা হাইড্রোজেন সালফাইডের লবণ নামে পরিচিত। কিছু কিছু আকরিক হচ্ছে সালফাইডের। ধাতব সালফাইড প্রায়শই কালো বর্ণের হয়। লেড এসিটেট কাগজ ব্যবহার করে হাইড্রোজেন সালফাইডের উপস্থিতি নির্ণয় করা হয়। হাইড্রোজেন সালফাইডের উপস্থিতিতে এই কাগজ ধূসর বর্ণ ধারণ করে এবং লেড সালফাইড গঠন করে। শক্তিশালী এসিডের সাথে ধাতব সালফাইড বিক্রিয়া করে হাইড্রোজেন সালফাইড উৎপন্ন করে।
গাঢ় নাইট্রিক এসিডের সংস্পর্ষে গ্যাসীয় হাইড্রোজেন সালফাইড রাখা হলে বিস্ফোরণ ঘটে।
হাইড্রোজেন সাইলফাইড এলকোহলের সাথে বিক্রিয়া করে থাইয়ল গঠন করে। থায়োল একটি গুরুত্বপূর্ণ জৈব সালফার যৌগ।
90 GPa এর অধিক চাপে হাইড্রোজেন সাইলফাইড ধাতব বিদ্যুৎ পরিবাহী হিসেবে কাজ করে।
উৎপাদন
সম্পাদনাহাইড্রোজেন সাইলফাইড সাধারণ সাওয়ার গ্যাস থেকে পাওয়া যায়। এটি একটি প্রাকৃতিক গ্যাস। এত উচ্চ পরিমাণে H
2S থাকে। সালফার ধাতুকে হাইড্রোজেন গ্যাসের সাথে প্রায় 450 °C তাপমাত্রায় বিক্রিয়া করালে হাইড্রোজেন সাইলফাইড পাওয়া যায়। এই প্রক্রিয়ায় হাইড্রোজেনকে হাইড্রোকার্বন প্রতিস্থাপন করে।[৯]
গবেষণাগারে ফেরাস সালফাইডকে শক্তিশালী এসিডের সাথে মিশ্রিত করে কিপ যন্ত্রে বিক্রিয়া ঘটিয়ে হাইড্রোজেন সালফাইড উৎপন্ন করা হয়ঃ
- FeS + 2 HCl → FeCl2 + H2S
হাইড্রোজেন সালফাইড তৈরীর একটি কম প্রচলিত পদ্ধতি হচ্ছে পানির সাথে এলুমিনিয়ান সালফাইডের বিক্রিয়াঃ[১০]
- 6 H2O + Al2S3 → 3 H2S + 2 Al(OH)3
কঠিন জৈব পদার্থের সাথে সালফারকে উত্তপ্ত করে এবং হাইড্রোজেনের সাথে সালফিউরেটেড জৈব পদার্থকে বিজারিত করে এই গ্যাস প্রস্তুত করা সম্ভব।
হাইড্রোজেন সাইলফাইড উৎপাদন ব্যয়বহুল কারণ এই গ্যাস উৎপাদনে বিপদের ঝুঁকি আছে।
উৎস
সম্পাদনাঅপরিশোধিত পেট্রোলিয়াম বা ক্রুড পেট্রোলিয়ামে সামান্য পরিমাণে হাইড্রোজেন সাইলফাইড পাওয়া যায়, কিন্তু প্রাকৃতিক গ্যাসে ৯০% পর্যন্ত হাইড্রোজেন সাইলফাইড পাওয়া যায়। আগ্নেয়গিরি এবং কিছু উষ্ণ ঝরণায় হাইড্রোজেন সাইলফাইড পাওয়া যায়। সম্ভবত সাইফাইড খনিজের হাইড্রোলাইসিসে এটা উৎপন্ন হয়।
MS + H
2O → MO + H
2S
হাইড্রোজেন সাইলফাইড কূপের পানিতে প্রাকৃতিক ভাবেই পাওয়া যায়। সালফেটকে বিজারিত করা ব্যাকটেরিয়ায় উপস্থিতির কারণেই এটা ঘটে। মানব শরীরে ক্ষুদ্রান্ত্রে সালফার বহনকারী প্রোটিনের ভাঙনে খুব সামান্য পরিমাণে হাইড্রোজেন সাইলফাইড উৎপন্ন হয়। হ্যালিটোসিসের কারণে মুখেও হাইড্রোজেন সাইলফাইড উৎপন্ন হতে পারে।[১১]
মানুষের কারণেই বৈশ্বিক H
2S নিঃসরণের পরিমাণ বৃদ্ধি পাচ্ছে। তেল রিফাইনারী প্রতিষ্ঠানসমূহ থেকে সব থেকে বেশি H
2S নিঃসৃত হয়। কয়লা, চূলা, সালফেট পদ্ধতি ব্যবহারকারী কাগজকল, ট্যানারি থেকেও H
2S নিঃসৃত হয়। উচ্চ তাপমাত্রায় সালফাল ধাতু কোন জৈব পদার্থের সংস্পর্ষে এলেই H
2S নিঃসৃত হয়।
২০১১ সালে রিপ্ররট থেকে জানা যায় যে তেল ক্ষেত্রের সম্প্রসারণের সাথে সাথে H
2S এর ঘনত্ব বৃদ্ধি পেয়েছে যা স্বাস্থ্য এবং পরিবেশ ঝুঁকি বাড়িয়ে দিয়েছে।[১২]
তাছাড়া গ্যাস এবং তেল উৎপাদন এবং প্রক্রিয়াকরণ স্থাপনার পাশে বসবাসকারী জনসাধারণ হাইড্রোজেন সালফাইডের সংস্পর্ষে আসে। দূষিত বাতাস সেবন অথবা দূষিত পানি পানেও হাইড্রোজেন সালফাইড দ্বারা আক্রান্ত হওয়ার সম্ভাবনা থাকে।[১৩]
ব্যবহার
সম্পাদনাথাই অর্গানিক যৌগ উৎপাদন
সম্পাদনাহাইড্রোজেন সালফাইড ব্যবহার করে মিথেন থাইয়ল, ইথেন থাইয়ল ও থায়োগ্লাইকোলিক এসিডসহ বেশ কিছু জৈব যৌগ প্রস্তুত করা হয়।
ক্ষারীয় ধাতব সালফাইডস উৎপাদন
সম্পাদনাক্ষারীয় ধাতুর সাথে সংযোগে হাইড্রোজেন সালফাইড ক্ষারীয় হাইড্রোসালফাইডস যেমন, সোডিয়াম হাইড্রোসালফাইড এবং সোডিয়াম সালফাইডে রুপান্তরিত হয় যা বাইপলিমারসমূহের ডিগ্রেডেশানে ব্যবহৃত হয়।
এনালাইটিক্যাল কেমিস্ট্রি
সম্পাদনাএক শতকেরও বেশি সময় ধরে হাইড্রোজেন সালফাইড ধাতব আয়নের কোয়ালিটিভ ইন অর্গানিক এনালাইসিসের জন্য এনালাইটিক্যাল কেমিস্ট্রিতে গুরুত্বপূর্ণ ছিলো। এই ধরনের বিশ্লেষণে, হাইড্রোজেন সালফাইডের সংস্পর্ষে ভারী ধাতব আয়নসমূহ যেমন Pb(II), Cu(II), Hg(II), As(III) এর অধঃক্ষেপ পড়ে। কিছু কারণে অধঃক্ষেপের উপাদানসমূহ পূনঃরায় দ্রবণে দ্রবীভূত হয়ে যেতে পারে।
বিশ্লেষণীয় রসায়ন বা এনালাইটিক্যাল কেমিস্ট্রিতে গবেষণাগারে অল্প পরিসরে ব্যবহারের জন্য সালফারের উৎস হিসেবে থায়োএসিটামাইডের পরিবর্তে H
2S ব্যবহার করা হয়।
ধাতব সালফাইডসমূহের কাঁচামাল
সম্পাদনাঅনেক ধাতব আয়ন হাইড্রোজেন সালফাইডের সাথে বিক্রিয়া করে উক্ত ধাতুর সালফাইড উৎপন্ন করে। এই পদ্ধতি বিভিন্ন ক্ষেত্রে ব্যবহার করা হয়। যেমনঃ হাইড্রোজেন সালফাইড দ্বারা গ্যাস অথবা পানি দূষিত হলে ধাতব সালফাইডে রূপান্তরিত করে দূষণমুক্ত করা হয়। ভাসমান বা ফ্লোটেশান পদ্ধতিতে ধাতব আকরিককে বিশুদ্ধ করার ক্ষেত্রে অধিকাংশ সময়ে খনিজ গুঁড়াকে হাইড্রোজেন সালফাইডের সাহায্যে আলাদা করা হয়।
বিবিধ ব্যবহার
সম্পাদনাডিউটেরিয়াম অক্সাইড বা সাধারণ পানি থেকে ভারী পানি পৃথকীকরণে গার্ডলার সালফাইড পদ্ধতিতে হাইড্রোজেন সালফাইড ব্যবহার করা হয়।
ইউনিভার্সিটি অফ এক্সটার এর বিজ্ঞানীরা আবিষ্কার করেছেন যে খুব সামান্য পরিমাণ হাইড্রোজেন সালফাইডের উপস্থিতি মাইট্রোকন্ড্রিয়াল ক্ষতিকে প্রতিরোধ করে, যখন কোষ রোগের কারণে দূর্বল হয়ে পড়ে তখন কোষাভ্যন্তরে এনজাইমের উপস্থিতিতে স্বল্প পরিমাণ হাইড্রোজেন সালফাইড উৎপন্ন হয়। এই গবেষণা থেকে স্ট্রোক, হৃদ পীড়া এবং আর্থ্রাইটিস প্রতিরোধ সম্ভব।[১৪]
হাইড্রোজেন সালফাইডের এন্টি-এজিং বৈশিষ্ট্য আছে যা কোষাভ্যন্তরের ধ্বংষাত্মক রাসায়নিককে বাঁধা প্রদান করে, রেড ওয়াইনে পাওয়া এন্টি-অক্সিড্যান্ট রেসভারেট্রলের সদৃশ বৈশিষ্ট্য বহন করে।[১৫]
জ্বালানি গ্যাস থেকে পৃথকীকরণ
সম্পাদনাহাইড্রোজেন সালফাইড সাধারণত প্রাকৃতিক গ্যাস, বায়োগ্যাস এবং তরলকৃত পেট্রোলিয়াম গ্যাসে (এলপিজি) পাওয়া যায়। একে কয়েকটি উপায়ে সরিয়ে ফেলা যায়।
- আয়রন অক্সাইডের সাথে বিক্রিয়া
- হাইড্রেটেড ফেরিক অক্সাইড পূর্ণ পাত্রের মধ্য দিয়ে গ্যাস প্রবাহিত করলে গ্যাসের হাইড্রোজেন সালফাইড অংশ আয়রন অক্সাইডের সাথে যুক্ত হয়।
- Fe
2O
3(s) + H
2O(l) + 3 H
2S(g) → Fe
2S
3(s) + 4 H
2O(l)
- Fe
- আয়রণ অক্সাইড পূণরায় ফিরে পেতে কন্টেইনারটিকে সরিয়ে এনে পানি এবং বাতাস দিয়ে পূর্ণ করতে হবে।
- 2 Fe
2S
3(s) + 3 O
2(g) + 2 H
2O(l) → 2 Fe
2O
3(s) + 2 H
2O(l) + 6 S(s)
- 2 Fe
- রিজেনারেশান শেষ হলে কন্টেইনারের পানি ফেলে দিয়ে পূনরায় ব্যবহার করা যাবে।[১৬]
- হাইড্রোডিসালফিরাইজেশান
- জ্বালানী থেকে সালফার পৃথকীরণে ব্যবহৃত হাইড্রোডিসালফিরাইজেশান একটি জটিল পদ্ধতি। এই পদ্ধতিটি বেশ ব্যয়বহুল।
পানি থেকে পৃথকীকরণ
সম্পাদনাখাবার পানি থেকে হাইড্রোজেন সালফাইড দূরীভূত করা একাধিক পদ্ধতি আছে। পানিতে বিদ্যমান ঘনত্বের উপর নির্ভর করে নির্দিষ্ট পদ্ধতি ব্যবহার করা হয়। খাবার পানিতে হাইড্রোজেন সালফাইডের উপস্থিতি অবশ্যই পরীক্ষা করে দেখা উচিত, বিশেষ করে ভূগর্ভস্থ পানির ক্ষেত্রে কারণ সেখানে খুব অল্প পরিমাণ দ্রবীভূত অক্সিজেন থাকে।[১৭]
নিরাপত্তা
সম্পাদনানিরাপত্তা
সম্পাদনানাকে মুখে মাস্ক,গ্লোভস,নিরাপদ চশমা,ব্যবহার করতে হবে। অগ্নি স্ফুলিঙ্গ হতে দুরে রাখতে হবে।
বহিঃসংযোগ
সম্পাদনাতথ্য উৎস
সম্পাদনা- ↑ "Hydrogen Sulfide - PubChem Public Chemical Database"। The PubChem Project। USA: National Center for Biotechnology Information।
- ↑ Perrin, D.D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution, 2nd Ed., Pergamon Press: Oxford, 1982.
- ↑ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432-433.
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, আইএসবিএন ০-০৭-০৪৯৪৩৯-৮
- ↑ ক খ Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A23। আইএসবিএন 0-618-94690-X।
- ↑ ক খ গ "NIOSH Pocket Guide to Chemical Hazards #0337" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- ↑ Hydrogen sulfide: Overview, National Pollutant Inventory, Australia
- ↑ Drozdov, A.; Eremets, M. I.; Troyan, I. A. (২০১৪)। "Conventional superconductivity at 190 K at high pressures" (পিডিএফ)। arxiv। 1412: 460। arXiv:1412.0460v1 । বিবকোড:2014arXiv1412.0460D। সংগ্রহের তারিখ ১ সেপ্টেম্বর ২০১৪।
- ↑ Jacques Tournier-Lasserve "Hydrogen Sulfide" in Ullmann's Encyclopedia of Chemical Industry
- ↑ McPherson, William (১৯১৩)। Laboratory manual। Boston: Ginn and Company। পৃষ্ঠা 445।
- ↑ উদ্ধৃতি ত্রুটি:
<ref>ট্যাগ বৈধ নয়;ATSDRনামের সূত্রটির জন্য কোন লেখা প্রদান করা হয়নি - ↑ "Holubnyak et al, SPE 141434-MS"। ১৪ অক্টোবর ২০১৩ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৪ মে ২০১৫।
- ↑ "HYDROGEN SULFIDE" (পিডিএফ)। Agency for Toxic Substances and Disease Registry। ২ এপ্রিল ২০১৫ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২৪ মে ২০১৫।
- ↑ Stampler, Laura। "A Stinky Compound May Protect Against Cell Damage, Study Finds"। Time। Time। সংগ্রহের তারিখ ১ ডিসেম্বর ২০১৪।
- ↑ Khan, Natasha। "Rotten Egg Gas Seen Offering Promise of Extending Life"। Bloomberg। Bloomberg। সংগ্রহের তারিখ ১ ডিসেম্বর ২০১৪।
- ↑ "Marcab Co Inc"। Marcab Co Inc.। সংগ্রহের তারিখ ২০১৩-১২-১৯।
- ↑ Lemley, Ann T.; Schwartz, John J.; Wagenet, Linda P.। "Hydrogen Sulfide in Household Drinking Water" (পিডিএফ)। Cornell University।
