কার্বনিক অ্যাসিড
- এটিকে কার্বোলিক অ্যাসিড এর সাথে জড়াবেন না। এটি ফেনল এর পুরাতন নাম।
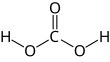
কার্বনিক অ্যাসিড( CARBONIC ACID ) হলো একটি রাসায়নিক যৌগ যার রাসায়নিক সূত্র হলো H2CO3 (OC(OH)2 এর সাথে সমান)। এটিকে অনেক সময় পানিতে কার্বন ডাইঅক্সাইড এর দ্রবণ (কার্বনেটেড জল) বলা হয়, কারণ এই ধরনের দ্রবণে অল্প পরিমাণে H2CO3 থাকে। শরীরবিদ্যায় কার্বনিক অ্যাসিডকে উদ্বায়ী অ্যাসিড বা শ্বাসপ্রদর অ্যাসিড হিসাবে বর্ণনা করা হয়, কারণ এটি একমাত্র অ্যাসিড হিসাবে ফুসফুসের গ্যাস দ্বারা নির্গত হয়।[২] অ্যাসিড-বেস হোমোস্টাসিস বজায় রাখতে বাইকার্বনেট বাফার প্রক্রিয়ায় গুরুত্তপুর্ন ভূমিকা পালন করে।
| |||
| নামসমূহ | |||
|---|---|---|---|
| পছন্দসই ইউপ্যাক নাম
কার্বনিক অ্যাসিড[১] | |||
| অন্যান্য নাম
কার্বন ডাইঅক্সাইড দ্রবণ
ডাইহাইড্রোজেন কার্বনেট হাইড্রোজেন বাইকার্বনেট বাতাসের অ্যাসিড বায়বীয় অ্যাসিড হইড্রোক্সিমিথনৈইক অ্যাসিড অঙ্গারাম্ল | |||
| শনাক্তকারী | |||
ত্রিমাত্রিক মডেল (জেমল)
|
|||
| সিএইচইবিআই | |||
| সিএইচইএমবিএল | |||
| কেমস্পাইডার | |||
| ইসিএইচএ ইনফোকার্ড | ১০০.১৩৩.০১৫ | ||
| ইসি-নম্বর |
| ||
| কেইজিজি | |||
পাবকেম CID
|
|||
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|||
| |||
| |||
| বৈশিষ্ট্য | |||
| H2CO3 | |||
| আণবিক ভর | ৬২.০৩ গ্রাম/মোল | ||
| ঘনত্ব | ১.৬৬৮ গ্রাম/সেমি3 | ||
| শুধুমাত্র দ্রবণে স্থায়ী | |||
| অম্লতা (pKa) | ৩.৬ (pKa1
শুধুমাত্র H2CO3 এর জন্য ), ৬.৩ (pKa1 CO2(aq) এর সাথে), ১০.৩২ (pKa2) | ||
| সম্পর্কিত যৌগ | |||
সম্পর্কিত যৌগ
|
আ্যসিটোন ইউরিয়া কার্বনিল ফ্লুরাইড | ||
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |||
| তথ্যছক তথ্যসূত্র | |||
কার্বনিক অ্যাসিড যা একটি দুর্বল অ্যাসিড, এটি কার্বনেট এবং বাইকার্বোনেট এই দুটি ধরনের লবণ গঠন করে। ভূতাত্ত্বিকতায়, কার্বনিক অ্যাসিড চুনাপাথরকে বিলুপ্ত করে ক্যালসিয়াম বাইকার্বোনেট তৈরি করে, যার স্ট্যালেকাইটস এবং স্টালগমাইটস এর মত অনেক চুনাপাথর এর বৈশিষ্ট্যগুলির মতো। এটা আগে থেকেই বিশ্বাস ছিল যে কার্বোনিক অ্যাসিড একটি বিশুদ্ধ যৌগ হিসাবে অবস্থান করে না। যাইহোক, ১৯৯১ সালে রিপোর্ট করা হয়েছিল যে নাসা বিজ্ঞানীরা কঠিন H2CO3 এর নমুনা তৈরিতে সফল হয়েছে।[৩]
রাসায়নিক সাম্যাবস্থা
সম্পাদনাযখন কার্বন ডাইঅক্সাইড জলে দ্রবীভূত করা হয় এটি কার্বনিক অ্যাসিডের সাথে রাসায়নিক ভারসাম্যে অবস্থান করে:[৪]
২৫ °C তাপমাত্রায় হাইড্রেশন সুস্থিতি ধ্রুবককে Kh বলে, যা বিশুদ্ধ জলে কার্বনিক অ্যাসিডের ক্ষেত্রে [H2CO3]/[CO2] ≈ ১.৭×১০−৩ [৫] এবং ≈ ১.২×১০−৩ সমুদ্র জলে.[৬]। সুতরাং, কার্বন ডাইঅক্সাইডের অধিকাংশই কার্বনিক অ্যাসিডে রূপান্তরিত হয় না, CO2 অণু হিসাবে থাকে। একটি অনুঘটক এর অনুপস্থিতিতে, ভারসাম্য খুব ধীরে ধীরে পৌঁছায়। হার ধ্রুবক গুলি হলো ০.০৩৯ s−1 সমমুখী বিক্রিয়াটির (CO2 + H2O → H2CO3) জন্য এবং ২৩ s−1 বিপরীতমুখী বিক্রিয়াটির জন্য (H2CO3 → CO2 + H2O)। CO2 এর সাথে ২ অণু জল যুক্ত করলে অর্থোকার্বনিক অ্যাসিড উৎপন্ন করবে, C(OH)4, যেটা জলীয় দ্রবণে খুব সামান্য পরিমাণে থাকে। বেশি পরিমাণ কার্বনিক অ্যাসিডের সাথে বেস যুক্ত করলে বাইকার্বনেট তৈরি করে। অতিরিক্ত বেস এর সাথে, কার্বনিক অ্যাসিড বিক্রিয়া করে কার্বনেট লবণ উৎপন্ন করে।
রক্তে কার্বনিক অ্যাসিডের ভূমিকা
সম্পাদনাবাইকার্বোনেট শ্বাসযন্ত্রের গ্যাস বিনিময় দ্বারা শরীরের বাইরে CO2 পরিবহন করে়। CO2 এর হাইড্রেশন বিক্রিয়া সাধারণত একটি অনুঘটকের অনুপস্থিতিতে খুব ধীরে হয়, তবে লাল রক্তের কোষগুলি কার্বনিক অ্যানহাইড্রেয ধারণ করে, যা বিক্রিয়া হার বাড়িয়ে দেয়, যা রক্তরসে বাইকার্বোনেট (HCO3−) তৈরি করে। এই অনুঘটক বিক্রিয়া ফুসফুসে বিপরীত, যেখানে এটি বাইকার্বোনেট কে CO2 তে রূপান্তরিত করে এবং এটি বহিষ্কৃত হতে দেয়। এই সামঞ্জস্য স্তন্যপায়ী রক্তের একটি বাফার হিসাবে গুরুত্বপূর্ণ ভূমিকা পালন করে।[৭] একটি ২০১৬ সালের তাত্ত্বিক প্রতিবেদন থেকে জানা যায় যে, কার্বোনিক অ্যাসিড রক্তের সিরামে বিভিন্ন নাইট্রোজেন বেস এর প্রোটননেটিং এ কেন্দ্রীয় ভূমিকা পালন করতে পারে।[৮]
সমুদ্র রসায়নে কার্বনিক অ্যাসিডের ভূমিকা
সম্পাদনামানবজীবন জীবাশ্ব জ্বালানি দহন এর ফলে যে CO2 ত্যাগ করে ,পৃথিবীর সাগর তার প্রায় অর্ধেক টাই শোষণ করে নেই।[৯] এটা অনুমান করা হয়েছে যে ,বেশি দ্রবীভূত CO2 সমুদ্র পৃষ্ঠ এর pH −০.১ পরিবর্তন করতে সমর্থ আছে প্রাথমিক শিল্প স্তর থেকে। এই তত্ত্বটি মহাসাগরীয় আসিডিফিকেশন নামে পরিচিত, যদিও সুমদ্রে ক্ষার থাকে।[১০]
কার্বনিক অ্যাসিডের অম্লত্ব
সম্পাদনাকার্বনিক অ্যাসিড হলো একটি পলিপ্রটিক অ্যাসিড, ―বিশেষভাবে এটা একটা ডাইপ্রটিক অ্যাসিড, যার মানে এটার দুটি প্রোটন আছে, যা মূল অণু থেকে আলাদা হতে পারে। সুতরাং সেখানে দুটি অ্যাসিড পৃথকীকরণ ধ্রুবক আছে, যার প্রথমটি বাইকার্বনেট (হইড্রোজেন কার্বনেট ও বলা হয়) আয়ন HCO3− এ ভেঙে যাওয়ার জন্য:
- Ka1 = ২.৫×১০−৪[৪] pKa1 = ৩.৬ ২৫℃ তাপমাত্রায়।
যত্ন নেওয়া উচিত কার্বনিক অ্যাসিডের প্রথম বিস্ফোরণ ধ্রুবক উদ্ধৃতি এবং ব্যবহার করার সময়। জলীয় দ্রবণে কার্বনিক অ্যাসিডটি, কার্বন ডাই অক্সাইডের সাথে সাম্যাবস্তায় থাকে, এবং H2CO3 এর ঘনত্ব খুব কম হয় CO2 এর ঘনত্বের চেয়ে। অনেক পরীক্ষায় H2CO3 কে দ্রবীভূত CO2 ধরা হয় (CO2(aq) হিসাবে গন্য করা হয়), H2CO3* কে দুটি উপাদানের জলীয় রাসায়নিক সামঞ্জস্য সমীকরণ লিখতে ব্যবহৃত হয়। সমীকরণকে পুনরায় এইভাবে লেখা হতে পারে:[৪]
- H2CO3* HCO3− + H+
- Ka(app) = ৪.৪৭×১০−৭; pK(app) = ৬.৩৫ ২৫℃ তাপমাত্রায় এবং আয়ণীয় শক্তি = ০.০
যেখানে প্রকৃত pKa কে কার্বনিক অ্যাসিডের পৃথকীকরণ ধ্রুবক হিসাবে উদ্ধৃত করে হয়েছে, এটা অস্পষ্ট: এটি দ্রবীভূত কার্বন ডাই অক্সাইডের অম্লীয় ধ্রুবকএর সাথে ভালো সম্পর্কযুক্ত হতে পারে। যেহেতু এটি CO2 এর pH গণনায় বিশেষভাবে ব্যবহৃত। সালফিউরাস অ্যাসিড (H2SO3) এর ক্ষেত্রেও একই পরিস্থিতি, যেটা শুষ্ক সালফার ডাই অক্সাইড এর সাথে সাম্যাবস্থায় থাকে। দ্বিতীয় ধ্রুবকটি বাইকার্বনেট আয়ণ এর কার্বনেট আয়নে CO32− ভেঙে যাওয়ার জন্য:
- Ka2 = ৪.৬৯×১০−১১; pKa2 = ১০.৩২৯ এবং আয়নিক শক্তি=০.০ ২৫℃ তাপমাত্রায়।
তিনটি অম্লীয় ধ্রুবক গুলি নিম্নরূপ:
pH এবং কার্বনিক অ্যাসিডের মিশ্রণ
সম্পাদনাএকটি নির্দিষ্ট তাপমাত্রায়, বিশুদ্ধ কার্বনিক অ্যাসিড দ্রবণের (অথবা বিশুদ্ধ CO2 দ্রবণ) সংযুক্তি সম্পূর্ণভাবে দ্রবনের উপর CO2 এর আংশিক চাপ দ্বারা নির্ধারিত হয়। এই সংযুক্তি গণনা করতে, কার্বনেট এর তিনটি বিভিন্ন গঠন (H2CO3, HCO3− এবং CO32−) এর সাম্যাবস্থা হিসাব নিতে হবে, এমনকি দ্রবীভূত CO2 এবং H2CO3 এর মধ্যে হাইড্রেশন সাম্যাবস্তা সাথে দ্রুবক এবং নিচের সাম্যাবস্থা দ্রবীভূত CO2 ও দ্রবনের উপরের CO2:
- CO2(gas) CO2(dissolved) সাথে যেখানে kH = ২৯.৭৬ atm/(mol/L) (হেনরি ধ্রুবক) ২৫℃ তাপমাত্রায়।
অনুরূপ সাম্যাবস্থা সমীকরণ গুলি এই সম্পর্ক এবং আধান প্রশমিত শর্ত এর সাথে ছয়টি সমীকরণ দেয় ছয়টি অজানা উপাদানের জন্য [CO2], [H2CO3], [H+], [OH−], [HCO3−] and [CO32−], দেখানো হচ্ছে যে দ্রবণের সংযুতি সম্পূর্ণ নির্ণয় করা হয়েছে দ্বারা। [H+] এর জন্য পাওয়া সমীকরণটি একটি ঘন, যার সংখ্যাসূচক সমাধান pH এবং বিভিন্ন উপাদানের ঘনত্বের নিম্নলিখিত মান গুলি দেয়।
| (atm) |
pH | [CO2] (mol/L) |
[H2CO3] (mol/L) |
[HCO3−] (mol/L) |
[CO32−] (mol/L) |
|---|---|---|---|---|---|
| ১০−৮ | ৭.০০ | ৩.৩৬ × ১০−১০ | ৫.৭১ × ১০−১৩ | ১.৪২ × ১০−৯ | ৭.৯০ × ১০−১৩ |
| ১০−৭ | ৬.৯৪ | ৩.৩৬ × ১০−৯ | ৫.৭১ × ১০−১২ | ৫.৯০ × ১০−৯ | ১.৯০ × ১০−১২ |
| ১০−৬ | ৬.৮১ | ৩.৩৬ × ১০−৮ | ৫.৭১ × ১০−১১ | ৯.১৬ × ১০−৮ | ৩.৩০ × ১০−১১ |
| ১০−৫ | ৬.৪২ | ৩.৩৬ × ১০−৭ | ৫.৭১ × ১০−১০ | ৩.৭৮ × ১০−৭ | ৪.৫৩ × ১০−১১ |
| ১০−৪ | ৫.৯২ | ৩.৩৬ × ১০−৬ | ৫.৭১ × ১০−৯ | ১.১৯ × ১০−৬ | ৫.৫৭ × ১০−১১ |
| ৩.৫ × ১০−৪ | ৫.৬৫ | ১.১৮ × ১০−৫ | ২.০০ × ১০−৮ | ২.২৩ × ১০−৬ | ৫.৬০ × ১০−১১ |
| ১০−৩ | ৫.৪২ | ৩.৩৬ × ১০−৫ | ৫.৭১ × ১০−৪ | ৩.৭৮ × ১০−৬ | ৫.৬১ × ১০−১১ |
| ১০−২ | ৪.৯২ | ৩.৩৬ × ১০−৪ | ৫.৭১ × ১০−৭ | ১.১৯ × ১০−৫ | ৫.৬১ × ১০−১১ |
| ১০−১ | ৪.৪২ | ৩.৩৬ × ১০−৩ | ৫.৭১ × ১০−৬ | ৩.৭৮ × ১০−৫ | ৫.৬১ × ১০−১১ |
| ১০০ | ৩.৯২ | ৩.৩৬ × ১০−২ | ৫.৭১ × ১০−৫ | ১.২০ × ১০−৪ | ৫.৬১ × ১০−১১ |
| ২.৫ × ১০০ | ৩.৭২ | ৮.৪০ × ১০−২ | ১.৪৩ × ১০−৪ | ১.৮৯ × ১০−৪ | ৫.৬১ × ১০−১১ |
| ১০১ | ৩.৪২ | ৩.৩৬ × ১০−১ | ৫.৭১ × ১০−৪ | ৩.৭৮ × ১০−৪ | ৫.৬১ × ১০−১১ |
- আমরা দেখতে পাচ্ছি যে মোট চাপের সীমার মধ্যে, pH সবসময় pKa2 এর চেয়ে অল্প, সুতরাং CO32− এর ঘনত্ব HCO3− এর ঘনত্বের তুলনায় নগন্য। যায় হোক CO32− কোনো সংখ্যাত্মক ভূমিকা পালন করে না বর্তমান গননায়। (নিচে দেখুন)
- এর অপসারণের জন্য, pH এক সময় বিশুদ্ধ জলের pH এর কাছাকাছি হয়, এবং দ্রবীভূত কার্বন মূলত HCO3− হিসাবে থাকে।
- সাধারণ বায়ুমণ্ডলীও শর্তে ( atm), আমরা মৃদু অম্লীয় (pH = ৫.৭) দ্রবণ পায়, এবং দ্রবীভূত কার্বন এখন মূলত CO2 হিসাবে থাকে। এই চাপে, [OH−] ও নগন্য, সুতরাং দ্রাবনের আয়ণীয় অংশটি এখন H+ এবং HCO3− এর সম-মোলার মিশ্রণ।
- CO2 এর জন্য, বোতলের কার্বনেটেড পানীয় এই চাপ টিপিক্যাল ( ~ ২.৫ atm), আমরা তুলনামূলকভাবে একটি অম্লীয় মাধ্যম (pH= ৩.৭) যেখানে দ্রবীভূত CO2 এর ঘনত্ব বেশি। এই বৈশিষ্টটি পানীয়টির টক এবং ঝালকানো স্বাদের জন্য দায়ী।
- ২.৫ থেকে ১০ atm চাপের মধ্যে, pH ছাড়িয়ে যায় pKa1 এর মানকে (৩.৬০), বেশি চাপে H2CO3 এর সর্বচ্চ ঘনত্ব দেয়(HCO3− এর সাপেক্ষে)।
- দ্রাবনের pH এর অপেক্ষক হিসাবে কার্বনের বিভিন্ন উপাদানের সাম্যাবস্থা ঘনত্বের যে রেখাচিত্র পাওয়া যায় সেটি বিজেরাম প্লট নামে পরিচিত।
- মন্তব্য
উপরে উল্লিখিত, এই নির্দিষ্ট সমস্যার জন্য [CO32−] অবজ্ঞা করা যেতে পারে, যা [H+] এর জন্য যথাযথ বিশ্লেষণ:
বিশুদ্ধ কার্বনিক অ্যাসিড
সম্পাদনাএটা দীর্ঘ বিশ্বাস ছিল যে কার্বনিক অ্যাসিড একটি বিশুদ্ধ যৌগ হিসাবে স্থায়ী হতে পারে না। যাইহোক, ১৯৯১ সালে নাসা এর বিজ্ঞানীরা গোডার্ড স্পেস ফ্লাইট সেন্টারে (মার্কিন যুক্তরাষ্ট্র) কঠিন H2CO3 এর নমুনা তৈরিতে সফল হয়।[৩] তারা উচ্চ-শক্তি প্রোটন বিকিরণে জল এবং কার্বন ডাই-অক্সাইডের হিমায়িত মিশ্রণকে ব্যবহার করেছিল এবং অতিরিক্ত জল অপসারণের জন্য উষ্ণ করেছিল। অবশিষ্ট কার্বনিক অ্যাসিডটি ইনফ্রারেড স্পেকট্রোস্কোপি দ্বারা চিহ্নিত করা হয়েছিল। কার্বনিক অ্যাসিড একটি কঠিন H2O + CO2 মিশ্রনের বিকিরণ দ্বারা প্রস্তুত করা হয়েছিল, অথবা শুষ্ক বরফের বিকিরণ দ্বারা, প্রস্তাবিত যে H2CO3 বাইরের স্থান বা মঙ্গলগ্রহে পাওয়া যেতে পারে যে, যেখানে H2O এবং CO2 এর হিমায়িত বরফ হয় পাওয়া যায়, সেইসাথে মহাজাগতিক রশ্মি।[১১][১২] এটি ১৯৯৩ সালে ঘোষণা করা হয়েছিল যে কঠিন কার্বনিক অ্যাসিড পটাশিয়াম বাইকার্বোনেট এবং হাইড্রোক্লোরিক অ্যাসিডের একটি ক্রায়োজেনিক প্রতিক্রিয়া দ্বারা মিথানলে দ্রবীভূত হয়ে তৈরি হয়।[১৩][১৪] পরে কাজ দেখিয়েছেন যে আসলে মিথাইল এস্টার গঠিত হয়েছিল, কিন্তু অন্যান্য পদ্ধতি সফল ছিল।[১২] তাত্ত্বিক গণনার মাধ্যমে দেখানো হয়েছে যে, এক অণু গ্যাস-ফেজ কার্বনিক অ্যাসিড অণুটির কার্বন ডাই অক্সাইড এবং জলে ভেঙে যাওয়াতে অনুঘটকের কাজ করতে পারে। জলের অনুপস্থিতিতে, গ্যাসীয় কার্বনিক অ্যাসিডের ভেঙে যাওয়াটা খুব ধীরে, যার অর্ধায়ু ১৮০,০০০ বছর।[১১] এটি শুধুমাত্র প্রযোজ্য, যদি অণুগুলি সামান্য কাছাকাছি হয়, কারণ এটিও অনুমান করা হয়েছে যে গ্যাস-ফেজ কার্বনিক অ্যাসিড ডাইমার তৈরি করে তার নিজস্ব বিভাজন ঘটায়, যা পরে প্রতিটি অণু জল এবং কার্বন ডাই অক্সাইড উৎপন্ন করে।[১৫] কিছু সময়ের জন্য মনে করা হতো যে কঠিন কার্বনিক অ্যাসিডের দুটি রূপ, যার নাম α এবং β। β-কার্বনিক অ্যাসিড ভিকুয়ামের মধ্যে বাইকার্বনেট এবং অ্যাসিডের ঘূর্ণনশীল স্তরসমূহকে গরম করে প্রস্তুত করা হয়, যার ফলে বাইকার্বনেটের প্রোটনেশন হয়, তারপর দ্রাবক অপসারণ করা হয়। পূর্বে প্রস্তাবিত যে α-কার্বনিক অ্যাসিড একই পদ্ধতিতে প্রস্তুত করা যায়, জলের তুলনায় মিথানাল ব্যবহার করে, পরে একটি মনমিথাইল এস্টার ( CH3OCOOH ) হতে দেখানো হয়েছিল।[১২]
আরও দেখুন
সম্পাদনাতথ্যসূত্র
সম্পাদনা- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)। Cambridge: The Royal Society of Chemistry। ২০১৪। পৃষ্ঠা 414, 781। আইএসবিএন 978-0-85404-182-4। ডিওআই:10.1039/9781849733069-FP001।
- ↑ Acid-Base Physiology 2.1 – Acid-Base Balance by Kerry Brandis.
- ↑ ক খ M. H. Moore; R. K. Khanna (১৯৯০)। "Infrared and mass spectral studies of proton irradiated H2O + CO2 ice: Evidence for carbonic acid"। Spectrochimica Acta Part A। ডিওআই:10.1016/0584-8539(91)80097-3।
- ↑ ক খ গ Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। পৃষ্ঠা 310। আইএসবিএন 0080379419।
- ↑ Housecroft and Sharpe, Inorganic Chemistry, 2nd ed, Prentice-Pearson-Hall 2005, p. 368.
- ↑ Soli, A. L.; R. H. Byrne (২০০২)। "CO2 system hydration and dehydration kinetics and the equilibrium CO2/H2CO3 ratio in aqueous NaCl solution"। Marine chemistry। 78 (2–3): 65–73। ডিওআই:10.1016/S0304-4203(02)00010-5।
- ↑ "excretion". Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.
- ↑ "Reaction Mechanism for Direct Proton Transfer from Carbonic Acid to a Strong Base in Aqueous Solution I: Acid and Base Coordinate and Charge Dynamics", S. Daschakraborty, P. M. Kiefer, Y. Miller, Y. Motro, D. Pines, E. Pines, and J. T. Hynes. J. Phys. Chem. B (2016), 120, 2271.
- ↑ Sabine, C. L.; ও অন্যান্য (২০০৪)। "The Oceanic Sink for Anthropogenic CO2"। Science। 305 (5682): 367–371। ডিওআই:10.1126/science.1097403। পিএমআইডি 15256665। জুলাই ৬, ২০০৮ তারিখে " মূল থেকে আর্কাইভ করা।
- ↑ National Research Council. "Summary". Ocean Acidification: A National Strategy to Meet the Challenges of a Changing Ocean. Washington, DC: The National Academies Press, 2010. 1. Print.
- ↑ ক খ Loerting, T.; Tautermann, C.; Kroemer, R. T.; Kohl, I.; Hallbrucker, E.; Mayer, A.; Liedl, K. R. (২০০০)। "On the Surprising Kinetic Stability of Carbonic Acid"। Angew. Chem. Int. Ed.। 39 (5): 891–895। ডিওআই:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E। পিএমআইডি 10760883।
- ↑ ক খ গ Reisenauer, H. P.; Wagner, J. P.; Schreiner, P. R. (২০১৪)। "Gas-Phase Preparation of Carbonic Acid and Its Monomethyl Ester"। Angew. Chem. Int. Ed.। 53 (44): 11766–11771। ডিওআই:10.1002/anie.201406969।
- ↑ Hage, W.; Hallbrucker, A.; Mayer, E. (১৯৯৩)। "Carbonic Acid: Synthesis by Protonation of Bicarbonate and FTIR Spectroscopic Characterization Via a New Cryogenic Technique"। J. Am. Chem. Soc.। 115 (18): 8427–8431। ডিওআই:10.1021/ja00071a061।
- ↑ "Press release: International First: Gas-phase Carbonic Acid Isolated" (ইংরেজি ভাষায়)। Technische Universität Wien। ১১ জানুয়ারি ২০১১। ৯ আগস্ট ২০১৭ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ৩ ফেব্রুয়ারি ২০১৮।
- ↑ de Marothy, S. A. (২০১৩)। "Autocatalytic decomposition of carbonic acid"। Int. J. Quantum Chem। 113 (20): 2306–2311। ডিওআই:10.1002/qua.24452। সংগ্রহের তারিখ ১৯ জানুয়ারি ২০১৫।
আরও পড়ুন
সম্পাদনা- Welch, M. J.; Lifton, J. F.; Seck, J. A. (১৯৬৯)। "তেজস্ক্রিয় অক্সিজেন-১৫ এর সঙ্গে অল্প অধ্যয়ন। কার্বন ডাই অক্সাইড এবং জলের মধ্যে বিনিময়"। J. Phys. Chem.। 73 (335): 3351। ডিওআই:10.1021/j100844a033।
- Jolly, W. L. (১৯৯১)। মডার্ন ইনোরগানিক কেমিস্ট্রি (২য় সংস্করণ)। New York: McGraw-Hill। আইএসবিএন 0-07-112651-1।
- Moore, M. H.; Khanna, R. (১৯৯১)। "ইনফ্রারেড এন্ড মাস স্পেকট্রাল স্টাডিজ অফ প্রোটন ইরিডিয়েডেড H2O + Co2 আইস: এভিডেন্স ফর কার্বনিক অ্যাসিড আইস, এভিডেন্স ফর কার্বনিক অ্যাসিড"। Spectrochimica Acta। 47A (2): 255–262। ডিওআই:10.1016/0584-8539(91)80097-3।
- W. Hage, K. R. Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (১৯৯৮)। "কার্বনিক অ্যাসিড ইন দ্য গ্যাস ফেজ এন্ড ইটস আ্যস্ট্রফিজিক্যাল রেলেভান্স"। Science। 279 (5355): 1332–1335। ডিওআই:10.1126/science.279.5355.1332। পিএমআইডি 9478889।
- Hage, W.; Hallbrucker, A.; Mayer, E. (১৯৯৫)। "এ পলিমরফ অফ কার্বনিক অ্যাসিড এন্ড ইটস পসিবল আ্যস্ট্রফিজিক্যাল রেলেভান্স"। J. Chem. Soc. Farad. Trans.। 91 (17): 2823–2826। ডিওআই:10.1039/ft9959102823।
বহিঃসংযোগ
সম্পাদনা- একটি সায়েন্টিস্টকে জিজ্ঞাসা করুন: কার্বনিক অ্যাসিড ডেকোম্পসিশন
- কেন এতদিন ধরে কার্বনিক অ্যাসিডের অস্তিত্বের সন্দেহ ছিল?
- জলের মধ্যে কার্বনিক অ্যাসিড / বাইকার্বোনেট / কার্বোনেট ভারসাম্য: দ্রব্যের pH, বাফার ক্ষমতা, টাইটট্রেশন এবং প্রজাতি বণ্টন বনাম pH মুক্ত স্প্রেডশীট
- জলে কার্বনিক অ্যাসিডের ঘনত্ব কীভাবে গণনা করতে হয়