বাইকার্বনেট
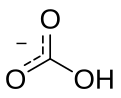
বাইকার্বনেট হলো অজৈব রসায়ন এর ( ইউপ্যাক নাম হলো -: হাইড্রোজেন কার্বোনেট ) । পলিয়েটমিক অ্যানিয়ন এর রাসায়নিক সংকেতটি হল HCO−
3 ।
| |
| |
| নামসমূহ | |
|---|---|
| পদ্ধতিগত ইউপ্যাক নাম
Hydroxidodioxidocarbonate(1−)[১] | |
| অন্যান্য নাম
Hydrogencarbonate[১]
| |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| থ্রিডিমেট | |
| বেইলস্টেইন রেফারেন্স | 3903504 |
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসি-নম্বর | |
| মেলিন রেফারেন্স | 49249 |
| কেইজিজি | |
পাবকেম CID
|
|
| ইউএনআইআই | |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| HCO− 3 | |
| আণবিক ভর | 61.0168 g mol−1 |
| লগ পি | −0.82 |
| অম্লতা (pKa) | 10.3 |
| Basicity (pKb) | 7.7 |
| অনুবন্ধী অম্ল | Carbonic acid |
| অনুবন্ধী ক্ষারক | Carbonate |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
বাইকার্বনেট পিএইচ বাফারিং সিস্টেমে একটি গুরুত্বপূর্ণ জৈব-রাসায়নিক শারীরবৃত্তীয় ভূমিকা হিসেবে পালন করে। [২]
"বাইকার্বনেট" শব্দটি ১৮১৪ সালে ইংরেজ রসায়নবিদ উইলিয়াম হাইড ওল্লাস্টন তৈরি করেছিলেন । [৩] "বাইকার্বনেট" এর উপসর্গ "দ্বি" একটি পুরানো নামকরণ সিস্টেম থেকে আসে এবং এটি পর্যবেক্ষণের ভিত্তিতে তৈরি হয় যে সেখানে দ্বিগুণ কার্বনেট রয়েছে ( CO2−
3 ) সোডিয়াম বাইকার্বনেট (NaHCO3) এবং অন্যান্য বাইকার্বনেটে সোডিয়াম কার্বনেট এবং অন্যান্য কার্বনেটগুলির চেয়ে সোডিয়াম আয়ন প্রতি [৪] ট্রিভিয়াল নাম হিসাবে বেঁচে থাকে।
উইকিপিডিয়া নিবন্ধ অনুযায়ী অজৈব রসায়ন IUPAC নামকরণের, প্রিফিক্স দ্বি- একটি একক হাইড্রজেন আয়ন উপস্থিতিতে । প্রস্তাবিত নামকরণ একক হাইড্রোজেন আয়ন উপস্থিতির সুস্পষ্ট রেফারেন্সিংকে আদেশ দেয়: সোডিয়াম হাইড্রোজেন কার্বনেট বা সোডিয়াম কার্বনেট । একটি সমান্তরাল উদাহরণ হ'ল সোডিয়াম বিসালফাইট (NaHSO3 )।
রাসায়নিক বৈশিষ্ট্য
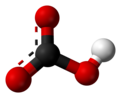
সম্পাদনাবাইকার্বনেট আয়ন (হাইড্রোজেনকার্বোনেট আয়ন) হ'ল HCO−
3 সূত্রের একটি অ্যানিয়ন HCO−
3 এবং৬১.০১ এর একটি আণবিক ভর ডাল্টনস এটিতে একটি কেন্দ্রীয় কার্বন পরমাণু গঠিত যা একটি ট্রিগনাল প্ল্যানার বিন্যাসে তিনটি অক্সিজেন পরমাণু দ্বারা বেষ্টিত থাকে, যার মধ্যে একটি হাইড্রোজেন পরমাণু একটি অক্সিজেনের সাথে সংযুক্ত থাকে। এটি নাইট্রিক অ্যাসিডযুক্ত আইসোইলেকট্রনিক HNO
3। বাইকার্বনেট আয়নটি একটি নেতিবাচক এক আনুষ্ঠানিক চার্জ বহন করে এবং অ্যাম্পিপ্রোটিক প্রজাতি যা অ্যাসিডিক এবং মৌলিক বৈশিষ্ট্য উভয়ই। এটি কার্বনিক অ্যাসিডের উভয়ই বেস H
2CO
3 ; এবং CO2−
3 এর কনজুগেট অ্যাসিড −CO2−
3 কার্বনেট আয়ন, যেমন এই ভারসাম্য প্রতিক্রিয়ার দ্বারা দেখানো হয়েছে:
- CO2−
3 + 2 H2O HCO−
3 + H2O + OH− H2CO3 + 2 OH−
- H2CO3 + 2 H2O HCO−
3 + H3O+ + H2O CO2−
3 + 2 H3O+.
একটি বাইকার্বনেট লবণ গঠন করে যখন একটি ইতিবাচক চার্জযুক্ত আয়নটি আয়নটির নেতিবাচক চার্জ অক্সিজেন পরমাণুকে সংযুক্ত করে, আয়নিক যৌগ গঠন করে। অনেকগুলি বাইকার্বনেটগুলি স্ট্যান্ডার্ড তাপমাত্রা এবং চাপে পানিতে দ্রবণীয় হয়; বিশেষত, সোডিয়াম বাইকার্বনেট মোট দ্রবীভূত দ্রবণগুলিতে অবদান রাখে, জলের গুণমান নির্ধারণের জন্য একটি সাধারণ পরামিতি |
শারীরবৃত্তীয় ভূমিকা
সম্পাদনাবাইকার্বনেট ( HCO−
3 ) মানবদেহের পিএইচ বাফারিং সিস্টেমের [২] একটি গুরুত্বপূর্ণ উপাদান ( অ্যাসিড-বেস বেসোস্টেসিস বজায় রাখা)। দেহের CO2 এর 70% –75% কে কার্বনিক অ্যাসিডে রূপান্তরিত করা হয় (H2CO3 ), যা HCO−
3 অ্যাসিড HCO−
3 এবং এটি দ্রুত রূপান্তর করতে পারে।
কেন্দ্রীয় মধ্যবর্তী প্রজাতি হিসাবে কার্বনিক অ্যাসিডের সাথে, বাইকার্বনেট - জল, হাইড্রোজেন আয়ন এবং কার্বন ডাই অক্সাইডের সংমিশ্রণে - এই বাফারিং সিস্টেমটি তৈরি করে, যা অ্যাসিড উভয়েরই পিএইচ পরিবর্তনের তাত্ক্ষণিক প্রতিরোধ সরবরাহ করতে প্রয়োজনীয় অস্থায়ী ভারসাম্য [২] বজায় রাখা হয় এবং মৌলিক দিক নির্দেশনা। এটি কেন্দ্রীয় স্নায়ুতন্ত্রের টিস্যু রক্ষার জন্য বিশেষভাবে গুরুত্বপূর্ণ, যেখানে উভয় দিকের স্বাভাবিক পরিসরের বাইরে পিএইচ পরিবর্তনগুলি বিপর্যয়কর প্রমাণ করতে পারে ।
বাইকার্বনেট হজম অনেক কাজ করে। উচ্চতর অম্লীয় হজম রস তাদের খাদ্য হজমে শেষ হওয়ার পরে এটি পেটের অভ্যন্তরীণ পিএইচ উত্থাপন করে। বাইকার্বনেট ক্ষুদ্র অন্ত্রের পিএইচ নিয়ন্ত্রণ করতেও কাজ করে। পেট থেকে ডুডেনিয়ামে প্রবেশকারী অ্যাসিডিক ছাইমকে নিরপেক্ষ করতে হরমোন সিক্রেটিনের প্রতিক্রিয়া হিসাবে এটি অগ্ন্যাশয় থেকে প্রকাশিত হয়। [৫]
পরিবেশে বাইকার্বনেট
সম্পাদনাবাইকার্বনেট সমুদ্রের জলে দ্রবীভূত অজৈব কার্বনের ,[৬] এবং বেশিরভাগ জলে চক্রটি এটি কার্বন চক্রের |
মিষ্টি জলে বাস্তুশাস্ত্রে, দিনের আলোতে মিষ্টি জলে উদ্ভিদের শক্তিশালী আলোকসংশ্লিষ্ট কার্যকলাপ জলে গ্যাসীয় অক্সিজেন ছেড়ে দেয় এবং একই সাথে বাইকার্বনেট আয়ন তৈরি করে। এগুলি পিএইচটিকে উপরের দিকে সরিয়ে নিয়ে যায় যতক্ষণ না নির্দিষ্ট পরিস্থিতিতে ক্ষারতার ডিগ্রি কিছু প্রাণীর পক্ষে বিষাক্ত হয়ে উঠতে পারে বা অন্যান্য রাসায়নিক উপাদান যেমন অ্যামোনিয়াকে বিষাক্ত করে তুলতে পারে। অন্ধকারে, যখন কোনও সালোকসংশ্লেষণ হয় না, শ্বসন প্রক্রিয়াগুলি কার্বন ডাই অক্সাইড প্রকাশ করে এবং কোনও নতুন বাইকার্বনেট আয়ন তৈরি হয় না, ফলস্বরূপ হ্রাস পায়।
অন্যান্য ব্যবহার
সম্পাদনাবাইকার্বনেট আয়নগুলির সাধারণ লবণটি হ'ল সোডিয়াম বাইকার্বনেট, NaHCO3, যা সাধারণত বেকিং সোডা নামে পরিচিত। অ্যাসিটিক অ্যাসিড জাতীয় কোনও অ্যাসিডের প্রকাশিত হলে সোডিয়াম বাইকার্বনেট কার্বন ডাই অক্সাইড নির্গত হয় । এটি বেকিংয়ের মধ্যে একটি খামির এজেন্ট হিসাবে ব্যবহৃত হয়।
বৃষ্টির জলে কার্বনিক অ্যাসিড দ্বারা পরিবেষ্টিত শিলা থেকে বাইকার্বনেট আয়নগুলির প্রবাহ কার্বন চক্রের একটি গুরুত্বপূর্ণ।
অ্যামোনিয়াম বাইকার্বনেট হজম বিস্কুট তৈরিতে ব্যবহৃত হয়।
কারণ নির্ণয়
সম্পাদনাডায়াগনস্টিক করা হয় ওষুধের সাহায্যে ,এবং শরীরে রক্তের বাইকার্বনেটের মান সূচকটি হ'ল অ্যাসিড – বেস ফিজিওলজি । ইলেক্ট্রোলাইট প্যানেল পরীক্ষায় বৈদ্যুতিন স্তর নির্ধারণ করার জন্য কার্বন ডাই অক্সাইড, ক্লোরাইড, পটাশিয়াম এবং সোডিয়াম গুলিকে এটি পরিমাপ করা হয় (যার বর্তমান কার্যবিধি টার্মিনোলজি, সিপিটি, কোড ৮০০৫১)।
প্যারামিটার স্ট্যান্ডার্ড বাইকার্বনেট ঘনত্ব এ রক্তে বাইকার্বনেট ঘনত্ব, সম্পূর্ণ অক্সিজেন স্যাচুরেশন এবং ৩৬ °C। সি। [৭]
বাইকার্বনেট যৌগ
সম্পাদনাআরো দেখুন
সম্পাদনা- কার্বন ডাই অক্সাইড
- কার্বনেট
- কার্বনিক এনহাইড্রাস
- খর পানি
- ধমনী রক্ত গ্যাস
তথ্যসূত্র
সম্পাদনা- ↑ ক খ "hydrogencarbonate (CHEBI:17544)"। Chemical Entities of Biological Interest (ChEBI)। UK: European Institute of Bioinformatics। IUPAC Names। ২০১৫-০৬-০৭ তারিখে মূল থেকে আর্কাইভ করা।
- ↑ ক খ গ "Clinical correlates of pH levels: bicarbonate as a buffer"। Biology.arizona.edu। অক্টোবর ২০০৬। ২০১৫-০৫-৩১ তারিখে মূল থেকে আর্কাইভ করা।
- ↑ William Hyde Wollaston (1814) "A synoptic scale of chemical equivalents," Philosophical Transactions of the Royal Society, 104: 1-22. On page 11, Wollaston coins the term "bicarbonate": "The next question that occurs relates to the composition of this crystallized carbonate of potash, which I am induced to call bi-carbonate of potash, for the purpose of marking more decidedly the distinction between this salt and that which is commonly called a subcarbonate, and in order to refer at once to the double dose of carbonic acid contained in it."
- ↑ "Baking Soda"। Newton – Ask a Scientist। Argonne National Laboratory। ২৬ ফেব্রুয়ারি ২০১৫ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২ মে ২০১৮।
- ↑ Berne & Levy, Principles of Physiology
- ↑ "The chemistry of ocean acidification : OCB-OA"। www.whoi.edu (ইংরেজি ভাষায়)। Woods Hole Oceanographic Institution। ২৪ সেপ্টেম্বর ২০১২। ১৯ মে ২০১৭ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৭ মে ২০১৭।
- ↑ Acid Base Balance (page 3) ওয়েব্যাক মেশিনে আর্কাইভকৃত ২০০২-০৬-১৩ তারিখে
বহিঃসংযোগ
সম্পাদনা- Bicarbonates যুক্তরাষ্ট্রের জাতীয় চিকিৎসা গ্রন্থাগারে চিকিৎসা বিষয়ক শিরোনাম (MeSH)