সোডিয়াম আয়োডেট
এই নিবন্ধটি ইংরেজী থেকে আনাড়িভাবে অনুবাদ করা হয়েছে। এটি কোনও কম্পিউটার কর্তৃক অথবা দ্বিভাষিক দক্ষতাহীন কোনো অনুবাদক কর্তৃক অনূদিত হয়ে থাকতে পারে। |
সোডিয়াম আয়োডেট একটি অজৈব যৌগ যার রাসায়নিক সংকেত NaIO3। এটি আয়োডিক অ্যাসিডের সোডিয়াম লবণ।
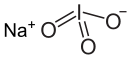
| |
| নামসমূহ | |
|---|---|
| অন্যান্য নাম
আয়োডিক অ্যাসিড, সোডিয়াম লবণ
| |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৮.৭৯৩ |
| ইসি-নম্বর |
|
পাবকেম CID
|
|
| আরটিইসিএস নম্বর |
|
| ইউএনআইআই | |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| INaO3 | |
| আণবিক ভর | ১৯৭.৮৯ g·mol−১ |
| বর্ণ | সাদা orthorhombic স্ফটিক |
| গন্ধ | গন্ধহীন |
| ঘনত্ব | 4.28 g/cm3 |
| গলনাঙ্ক | ৪২৫ °সে (৭৯৭ °ফা; ৬৯৮ K) (anhydrous) decomposes[৩] ১৯.৮৫ °সে (৬৭.৭৩ °ফা; ২৯৩.০০ K) (pentahydrate) |
| 2.5 g/100 mL (0 °C) 8.98 g/100 mL (20 °C) 9.47 g/100 mL (25 °C)[১] 32.59 g/100 mL (100 °C)[২] | |
| দ্রাব্যতা | Soluble in acetic acid Insoluble in alcohol |
| দ্রাব্যতা in dimethylformamide | 0.5 g/kg[১] |
| −53.0·10−6 cm3/mol | |
| গঠন | |
| স্ফটিক গঠন | Orthorhombic |
| তাপ রসায়নবিদ্যা | |
| তাপ ধারকত্ব, C | 125.5 J/mol·K[১] |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
135 J/mol·K[১] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−490.4 kJ/mol[১] |
গিবসের মুক্ত শক্তি (ΔfG˚)
|
35.1 kJ/mol[১] |
| ঝুঁকি প্রবণতা | |
| জিএইচএস চিত্রলিপি |    [৪] [৪]
|
| জিএইচএস সাংকেতিক শব্দ | বিপদজনক |
| জিএইচএস বিপত্তি বিবৃতি | H272, H302, H317, H334[৪] |
| জিএইচএস সতর্কতামূলক বিবৃতি | P220, P261, P280, P342+311[৪] |
| এনএফপিএ ৭০৪ | |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ)
|
108 mg/kg (mice, intravenous)[১] |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
সোডিয়াম আয়োডাইড সোডিয়াম পারআয়োডেট Sodium bromate Sodium chlorate |
অন্যান্য ক্যাটায়নসমূহ
|
Potassium iodate Silver iodate |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
প্রস্তুতি
সম্পাদনাসোডিয়ামযুক্ত ক্ষার যেমন সোডিয়াম হাইড্রোক্সাইডের সাথে হাইড্রোআয়োডিক অ্যাসিডের বিক্রিয়া করে সোডিয়াম আয়োডেট তৈরি করা হয়I উদাহরণ স্বরূপ:
HIO3 + NaOH → NaIO3 + H2O
সোডিয়াম হাইড্রোক্সাইড অথবা সোডিয়াম কার্বনেটের উত্তপ্ত ঘন দ্রবণে আয়োডিন যুক্ত করেও এটি প্রস্তুত করা যেতে পারে:
3 I2 + 6 NaOH → NaIO3 + 5 NaI + 3 H2O
ধর্ম
সম্পাদনাসোডিয়াম আয়োডেট একটি জারক পদার্থ। এটি দেখতে কেলাসাকার এবং সাদা রঙের হয়। জলের থেকে চার গুণেরও বেশি ভারী। এর ঘনত্ব ৪.২৮ গ্রাম/সিসি এবং গলনাঙ্ক ৪২৫ ডিগ্রি সেলসিয়াস।
বিক্রিয়া
সম্পাদনাসোডিয়াম আয়োডেট লবণের জলীয় দ্রবণে হাইপোক্লোরাইট অথবা অন্য কোনো শক্তিশালী জারক পদার্থের দ্রবণ দিলে এটি জারিত হয়ে সোডিয়াম পারআয়োডেট এ পরিণত হয়:
NaIO3 + NaOCl → NaIO4 + NaCl
ব্যবহার
সম্পাদনাদৈনন্দিন জীবনে আয়োডিনযুক্ত লবণে সোডিয়াম আয়োডেটের প্রধান ব্যবহার দেখা যায়।
তথ্যসূত্র
সম্পাদনা- ↑ ক খ গ ঘ ঙ চ ছ http://chemister.ru/Database/properties-en.php?dbid=1&id=759
- ↑ Seidell, Atherton; Linke, William F. (১৯১৯)। Solubilities of Inorganic and Organic Compounds (2nd সংস্করণ)। D. Van Nostrand Company।
Results here are multiplied by water's density at temperature of solution for unit conversion. - ↑ Lide, David R. (১৯৯৮)। Handbook of Chemistry and Physics (87 সংস্করণ)। Boca Raton, Florida: CRC Press। পৃষ্ঠা 4–85। আইএসবিএন 0-8493-0594-2।
- ↑ ক খ গ Sigma-Aldrich Co. Retrieved on 2014-05-25.
